Ion-reaktioner & Ion forbindelser
Denne figur viser dannelsen af sølv-chlorid, udfra tilsætningen af AgNO3 til en
opløsning af NaCl.
Na+ og NO3- befinder sig i vand både før og efter
reaktionen, mens Ag+ og Cl- efter reaktionen sidder
sammen i et gitter.
Dette kaldes en fældningsreaktion. Ovenstående reaktion kan skrives i kemisprog
på følgende måde:
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
Sølvchlorid der er blevet dannet, er tungtopløseligt i vand. Herved fremkommer
der et bundfald.
Et stof der er tungtopløseligt i vand defineres som et stof hvor der maximalt
kan opløses 2g stof pr 100 g Vand.
Alle ionforbindelser er opbygget af et gitter hvor de positive og negative
ioner sidder sammen i et gitter, der kan have mange former.
Mest kendt er nok NaCl`s gitter, der er opbygget som en terning.
En model ses her:

Ionbindingen er yderst stærk, og derfor har de fleste ionforbindelser høje
smelte- og kogepunkter.
De leder den elektriske strøm.
Eksempel: saltvand vil lede den elektriske strøm, det gør sukkervand ikke…
Det viser billedet herunder… (fra 8a - okt. 2001)
Sukker er et molekyle - se afsnittet om sukker
Ionforbindelser, som udelukkende indeholder grundstoffer fra hovedgrupperne er
farveløse, dog er nogle forbindelser af Sn og Pb farvede.
Mange ionforbindelser, der indeholder grundstoffer fra undergrupperne (+ gr.
VIII) er farvede.
fx. NiSO4 ( grøn) KMnO4 der er stærk violet.
Når ionforbindelser er stærke burde man egentlig forvente at de er uopløselige
i alle opløsningsmidler.
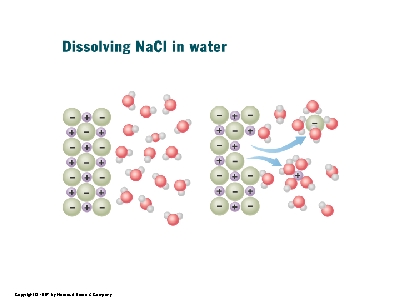
Men vi har set vands "elektriske" egenskaber.
Vand har en positiv ende ved H-atomerne og en negativ ende ved O-atomet
Her kan der dannes ret stærke bindinger mellem ioner og vandet. Herved
nedbrydes gitteret.
Man siger at ionerne hydratiseres, vi andre siger saltet opløses.
Billedet herunder viser processen "Dissolving" betyder at opløse
Ud fra det periodiske system kan man aflæse visse grundstoffers evne til at
danne ioner.
Hovedgruppe 1 danner + ioner
Hovedgruppe 2 danner 2+ioner
Hovedgruppe 6 danner 2- ioner
Hovedgruppe 7 danner 1-ioner
Herved er der opfyldt en regel der siger det er smart med 8 elektroner i den
yderste skal.

”Perhaps one of you gentlemen would mind telling me just what it is outside the
window that you find so attractive”
”Vil en af d’herre fortælle mig hvad der på den
anden side af vinduet I finder så tiltrækkende”
I hoved gruppe afgiver Na let den yderste hvorved der bliver 8 tilbage i bane
nr. 2. Og Cl modtager let en, hvorved der opstår 8 elektroner i dens yderste
skal. (i stedet for de 7 der var)
Ion betyder vandring, og her er det så elektroner der vandrer. I øvrigt er de
fleste af de negative ioner vi har med at gøre såkaldt sammensatte ioner, der
kan ses i en tabel. Her kan
du få sådan en tabel frem
En sammensat ion er af typen: SO42- (sulfat
- ionen).