Bindinger
Bindinger - sammensætninger mellem atomer - kan finde sted på følgende måde, vi
taler om kræfter der holder molekylerne eller andre kemiske forbindelser
sammen. Og her er det værd at huske på:
-
Kernen er positiv ladet
-
Elektronerne (udenom kernen) er negativ ladet.
-
Det er tiltrækningen mellem disse positive og negative ladninger der holder sammen på tingene
Vi vil i folkeskolen operere med 3 typer:
-
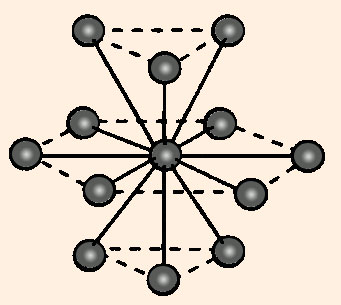
ion bindingen: Her flyttes der elektroner fra et atom til at andet, oftest sådan at et metal afgiver ioner, ikke metaller modtager ioner. Den elektriske ladning i det enkelte atom ændres fra at være neutral til at vær positiv, hvis der afgives en eller flere elektroner. Den mest kendte er NaCl - almindeligt salt, nedenfor ses Højene Skoles model af dette iongitter:
-
Den covalente binding: her deler to atomer et eller flere elektronpar:( kaldes også elektronparbindingen)
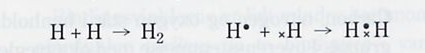
eller måske bedre:
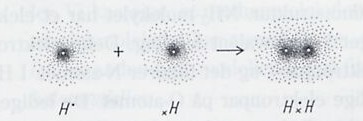
DET KAN VÆRE SVÆRT AT SKELNE MELLEM COVALENTE BINDINGER OG IONBINDINGER.
Hvis forskellen i elektronegativitet er > 2 så er det en ren ionbinding.
De sammensatte ioner, oftest de negative, er sammensatte af en covalent binding med en eller flere elkeroner i overskud
-
Metalbindingen: Ved denne binding i faste metalliske stoffer afgiver metalatomerne de næsten mege tløst bundne elektroner til metallet som helhed. Disse elektroner kan bevæge sig frit i krystallen og danner en negativt ladet elektronsky, som holder de positivt ladede metalioner på plads. Det er i øvrigt gennem disse mage "fælles" elektroner bevæger sig . Metallerne lægger sig nogenlunde sådan her: