Atomernes opbygning mm.
(med illustration længere fremme)
Alt hvad man kan forestille sig er opbygget af molekyler der igen er
opbygget af de omkring 106 grundstoffer vi kender. Når jeg skriver alt
mener jeg alt. Det gælder lige fra leverpostejmaden til vores arveanlæg.
Tænk på molekyler som ordene i en bog , og de enkelte grundstoffer som bogstaverne.
Hermed er det logisk at et grundstof består af 1 eller flere ens atomer,
mens en kemisk forbindelse består af forskellige slags atomer bundet sammen.
Altså igen: et grundstof er et atom med lige præcis de egenskaber der gør det
til netop dette grundstof.
Atomerne har dog nogle fælles egenskaber, nemlig de smådele et atom består af.
Disse smådele kan opdeles i 2 grupper:
1)
Atomkernen: Denne består af Protoner, der har en
positiv elektrisk ladning , og Neutroner, der er elektrisk neutrale
2)
Elektroner: Det er nogle meget små tingester, der i
hvert fald til vores brug kredser i nogle baner omkring atomets kerne.
Elektonerne er elektrisk negativt ladede, og deres antal er under normale
omstændigheder det samme som protonernes. Der findes normalt op til 7
baner, og der er en grænse for hvor mange elektroner der kan være i hver bane,
ja det kan faktisk udregnes efter en lille nem regel: antal maksimale
elektroner i bane nr "n" er 2 * n2.
Det vil sige at for bane nr. 2 (n=2) kan der være 2*22=8.
I det periodiske system som hænger i lokalet, kan I se en række røde tal, der faktisk er fortløbende. Disse tal er atomnummeret, og angiver hvor mange protoner der er i det pågældende grundstof. Man kan osse sige, at det er antallet af protoner, der fortæller en, hvad det er for et grundstof man har. (samtidigt fortæller dette os osse antallet af elektronerne, fordi der skal være elektrisk ligevægt, det vil sige lige mange positive og negative ladninger)
Opgave: Hvor mange protoner er der i et jern-atom (Fe), bly-atom (Pb), Chlor-atom (Cl), Guld-atom (Au) og Sølv-atom (Ag)?
Foreløbigt har det været rimeligt nemt at udregne antal protoner og elektroner, men af praktiske grunde vil vi da osse gerne vide antal af neutronerne.
NB: det er sjældent det samme som antallet af protoner.
For at kunne det må vi indføre nogle vægtenheder (vi burde egentlig sige masse), og fastslå følgende:
- protonen har vægten 1u
- neutronen har også massen 1u
- elektronen en masse på 1/1873u
Da 55,85g jern indeholder
602000000000000000000000 jernatomer, kan man nok forstå at en u er et meget
lille tal. Det store tal kan skrives som 6,02 * 1023.
Vi vender senere tilbage til enheden u. Kig på det periodiske system i Jeres
bog. Der vil I se nogle tal der angiver atommassen: Dette tal er summen af
protonernes og neutronernes masse.
Eksempel: Find nr. 26 (Fe). Massen er 55,85u, dette afrundes til 56,00=56. Vi
ved nu at jern har nummer 26, dvs 26 protoner, der vejer 26*1u= 26u. Resten må
så være neutronernes masse i u, og da de jo osse vejer 1u, må antallet af
neutroner være de 56-26=30u=30 neutroner
Altså: Atommassen (afrundet) minus antal protoner = antallet af neutroner.
Opgave: Udregn antallet af neutroner for følgende grundstoffer: Sm, Na, Mg,
Cr, Y, Cl, Kr og endelig Zn., Desuden tegn en model for de første 18
grundstoffers opbygning, (Kerne + baner).
ATOMER OG DERES OPBYGNING
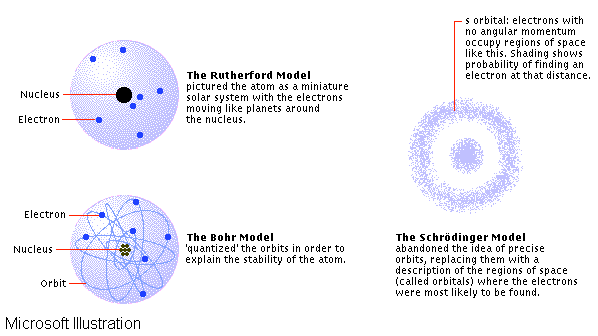
Ovenstående figur viser de 3 modeller man har opereret med gennem tiderne.
Læg mærke til at man i dag ved det er orbital-modellen der opererer med
sandsynligheder der er den "rigtige".
Men hvorfor så stadig undervises i skal/bane modellen ?
Jo den er god til at forklare egenskaber som ion dannelse, kemiske
reaktionstyper og lignende med.
Der er mere styr på elektronerne end i Scrödinger modellen.